Cuando necesitamos medidas precisas de pH debemos tener en cuenta las potenciales fuentes de error. En esta entrada consideraremos los efectos de la temperatura en la medida del pH. La temperatura tiene efectos tanto en las soluciones que necesitamos medir como en los propios instrumentos de medida. El pH es una medida de la acidez o alcalinidad de una solución y se define con respecto a la concentración de iones hidrógeno presentes (menos logaritmo en base 10 de la actividad de iones hidrógeno).
La temperatura puede afectar a la medida del pH porque modifica la actividad de los iones de la solución muestra, de los buffers (en las calibraciones) y a las solubilidades de los ácidos o bases débiles y también al comportamiento de las membranas e iones de los electrodos de medida. Comentaremos alguno de estos efectos y la mejor forma de evitar posibles errores.
Efectos sobre el electrodo
Cuando nos separamos de las condiciones estándar (1 M, 1 atm, 298 k o 25 ºC) la respuesta del electrodo queda definida por la ecuación de Nernst : E=E0-2.3 (RT/nF) log aH+
Aunque la discusión de esta ecuación fundamental queda fuera del propósito de esta entrada, se puede ver con claridad que cualquier cambio en la temperatura ( T ) modifica el valor de la medida. Por esta razón desde hace un tiempo se ofrecen equipos con ATC (compensación automática de la temperatura), para lo que es necesario una medida precisa de la temperatura. Esta medida puede hacerse mediante una sonda de temperatura independiente del electrodo o bien pueden utilizarse electrodos integrados capaces de medir simultáneamente potencial y temperatura.
Equilibrio térmico
Para medidas muy precisas un aspecto esencial que debemos tener en cuenta es el equilibrio térmico entre las soluciones de calibración, soluciones muestra y electrodos. Debemos hacer las calibraciones a la temperatura especificada por los buffers y deberíamos hacer la medida de las muestras a esa misma temperatura siempre que sea posible.
La falta de equilibrio térmico ocasionado por variaciones de temperatura de las soluciones o entre éstas y el electrodo que estamos usando (por introducirlo sucesivamente en diferentes muestras a diferente temperatura) ocasionará derivas y una respuesta lenta o inestable. En un laboratorio lo ideal para evitar este posible error es calibrar y medir las muestras en un baño de agua termostático a temperatura controlada.
Efectos sobre las soluciones
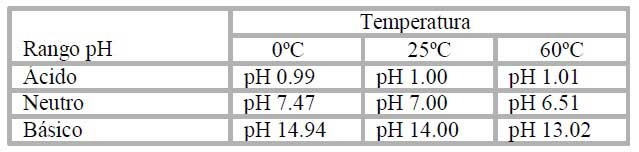
Un aumento de la temperatura aumentará la solubilidad y la disociación de las sales, ácidos y bases (especialmente de ácidos y bases débiles) aumentando la concentración de iones en la solución. Además al aumentar la temperatura disminuirá la viscosidad y se incrementará la movilidad de los iones. Como el pH es una medida de la concentración de protones su modificación por efecto de la temperatura modificará la medida de pH.
Ya hemos comentado antes el efecto directo de la temperatura sobre el potencial de electrodo, si observamos nuevamente la ecuación de Nernst vemos que las variaciones en la actividad del ion hidrógeno (log aH+ ) también afectan a su respuesta modificando por tanto la medida de pH.
Conclusiones
La temperatura tiene efectos sobre la medida del pH porque su variación afecta a todos los elementos implicados, buffers de calibración, muestras, y electrodos, que debemos conocer y tener en cuenta cuando necesitamos medidas de precisión.
Para preparar las soluciones de calibración (buffers) debemos respetar la temperatura de trabajo indicada por el fabricante, este punto es crítico para evitar errores de medida.
Para la medida en las muestras la mejor opción es realizarla a la temperatura de calibración, si no fuese posible, usar equipos con ATC o bien recurrir a tablas que nos permitan corregir el valor. Los baños termoestáticos también pueden ser una buena opción para medidas de alta precisión.
Siempre que midamos a una temperatura diferente a la de calibración debemos anotarla junto al valor de pH obtenido para que resulte reproducible.
Con respecto al electrodo ya hemos expuesto que la temperatura es una variable que afecta directamente al potencial que mide el electrodo y además puede causar un efecto cinético modificando la movilidad de los iones en las membranas provocando inestabilidad, derivas o respuestas lentas.



Me encanta leer sus publicaciones, que bueno que haya personas que se preocupan por generar buen contenido
Su Bolg es muy util, gracias.
Cuánto es el valor del pH del agua a una temperatura de 37°C
el pH desminuye
esa informacion la puedes encontrar en el Manual del Ingeniero Quimico – Perry
Paola el valor del ph del agua a 37 grados depende de que valor tiene a 25 grados